Visor de glosario
Diccionario de Citología
- A
- ATP-asas
- Es un conjunto multienzimático, cuya función es obtener la energía necesaria para los procesos metabólicos a partir de ATP. Son capaces de producir la hidrólisis del adenosín trifosfato (ATP) en adenosín difosfato (ADP) y un ión de fósforo (ión fosfato) libre. Esta reacción libera energía, la cual es utilizada en la mayoría de los casos para poder llevar a cabo otra reacción química. Algunos ejemplos de su utilización son: participa en el metabolismo celular ,en el metabolismo de los desechos, y solutos que pueden obstaculizar los procesos celulares.
Las ATPasas se suelen encuentrar en la membrana con un extremo en cada lado. Las ATPasas suelen formar parte de canales de solutos en contra de gradiente a través de las membranas. Es decir, la célula quiere concentrar un soluto en un compartimento membranoso por ejemplo una vacuola, el núcleo, etc. Necesita gastar energía para meter el soluto, si quiere concentrarlo más allá de equilibrio de cargas eléctricas entre ambos compartimentos, por lo que cogen ATP de un lado de la membrana y al desfosforilarlo (convertirlo en ADP + Pi) obtiene energía que empleará la enzima para coger el soluto (iones o moléculas orgánicas) y transportarlo a través de la membrana.
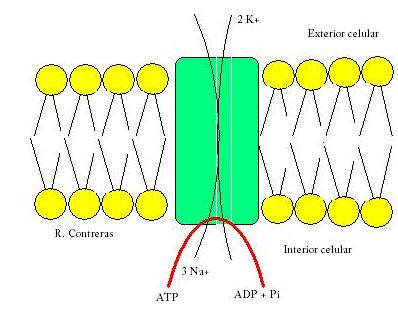
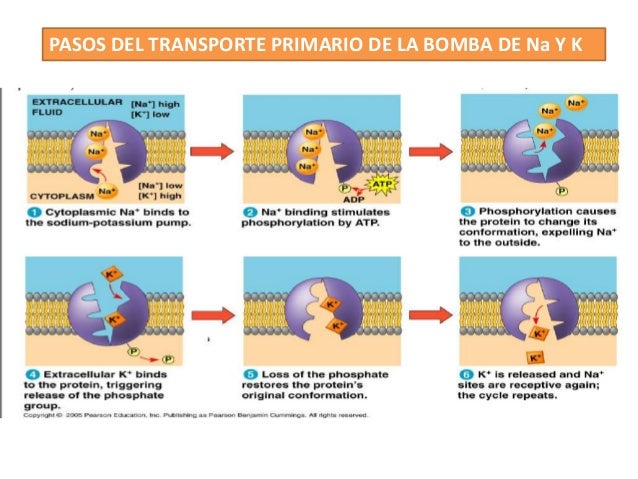
Un ejemplo:
Bomba Sodio-Potasio
Un ejemplo es la bomba Sodio-Potasio, en ella se intercambian a través de la membrana celular, entre la membrana y el medio extracelular dos iones de Na+ y tres de K+. La presión osmótica continua constante ya que se saca más ones de las que entran, por lo que el citoplasma se queda cargado negativamente, y permite la entrada de otros solutos con carga positiva necesarios. Además, el Na+ estimula la entrada de otros solutos importantes que se asocian a él.
Los procesos que tienen lugar en el transporte son:- Unión de tres Na+ a sus sitios activos.
- Fosforilación de la cara citoplasmática de la bomba que induce a un cambio de conformación en la proteína.
- El cambio de conformación hace que el Na+ sea liberado al exterior.
- Una vez liberado el Na+, se unen dos iones de K+ a sus respectivos sitios de unión de la cara extracelular de las proteínas.
- La proteína se desfosforila produciéndose un cambio conformacional de ésta, lo que produce una transferencia de los iones de K+ al citosol.
webgrafía:
http://es.wikipedia.org/wiki/Bomba_sodio-potasio
http://campodocs.com/articulos-enciclopedicos/article_93901.html
http://biologia.laguia2000.com/bioquimica/atpasa
- Apoptosis
- Apoptosis La apoptosis es un proceso ordenado basado en la muerte fisiológica de la célula programada por ella misma. Ésta, se da ante estímulos que pueden ser extracelurares como las citoquinas (TNF), radiaciones y la ausencia de señales hormonales o de factores tróficos, e intracelulares como la mitosis incompleta, el aumento del calcio citoplasmático o los daños irreparables del ADN.
 Tras esta activación por los estímulos, se da una cascada proteolítica que genera la condensación de los orgánulos y la fragmentación del núcleo y de las enzimas reparadoras de ADN y de las proteínas del citoesqueleto de la célula así como la activación de las endonucleasas.
Tras esta activación por los estímulos, se da una cascada proteolítica que genera la condensación de los orgánulos y la fragmentación del núcleo y de las enzimas reparadoras de ADN y de las proteínas del citoesqueleto de la célula así como la activación de las endonucleasas.
 Si son estímulos extracelulares, la unión de proteínas extracelulares activará las caspasas,que generarán los cortes en las proteínas y ADN por su cisteína en su centro activo. En cambio, si son intracelulares y se produce un daño celular por radiación o compuestos tóxicos, el proceso de apoptosis será iniciado por proteínas pro-apoptóticas y se inhibirán las proteínas anti-apoptóticas de la familia Bcl-2 (B-cell lymphoma). Asímismo, en ambos casos, como respuesta a los estímulos, se formará el apoptosoma tras la liberación al citosol de la proteína citocromo c por parte de la mitocondria que ha sufrido daños o estrés y pierde su función. El citocromo c activará las caspasas al unirse a la proteína Apaf-1.
Si son estímulos extracelulares, la unión de proteínas extracelulares activará las caspasas,que generarán los cortes en las proteínas y ADN por su cisteína en su centro activo. En cambio, si son intracelulares y se produce un daño celular por radiación o compuestos tóxicos, el proceso de apoptosis será iniciado por proteínas pro-apoptóticas y se inhibirán las proteínas anti-apoptóticas de la familia Bcl-2 (B-cell lymphoma). Asímismo, en ambos casos, como respuesta a los estímulos, se formará el apoptosoma tras la liberación al citosol de la proteína citocromo c por parte de la mitocondria que ha sufrido daños o estrés y pierde su función. El citocromo c activará las caspasas al unirse a la proteína Apaf-1. Por último, se da una fagocitosis, consecuencia de la variación de distribución de los lípidos de la membrana plasmático, pues la fosfatildilserina, un fosfolípido presente normalmente sólo en la cara interna de la bicapa lipídica, se cambia a la cara externa actuando como señal de reconocimiento por los fagocitos.
Por último, se da una fagocitosis, consecuencia de la variación de distribución de los lípidos de la membrana plasmático, pues la fosfatildilserina, un fosfolípido presente normalmente sólo en la cara interna de la bicapa lipídica, se cambia a la cara externa actuando como señal de reconocimiento por los fagocitos. Así, la apoptosis juega un papel clave en procesos como el desarrollo embrionario y su remodelado (zonas interdigitales), de órganos y sistemas, especialmente el del sistema nervioso, el mantenimiento de poblaciones celulares mediante la homeostasis, el equilibrio entre muerte y división celular y la defensa frente a patógenos y tumores, los cuales pueden darse por una resistencia al proceso apoptósico, que también genera malformaciones y enfermedades autoinmunes. Sin embargo, un exceso de apoptosis puede conllevar enfermedades neurodegenerativas.Bibliografía:
Así, la apoptosis juega un papel clave en procesos como el desarrollo embrionario y su remodelado (zonas interdigitales), de órganos y sistemas, especialmente el del sistema nervioso, el mantenimiento de poblaciones celulares mediante la homeostasis, el equilibrio entre muerte y división celular y la defensa frente a patógenos y tumores, los cuales pueden darse por una resistencia al proceso apoptósico, que también genera malformaciones y enfermedades autoinmunes. Sin embargo, un exceso de apoptosis puede conllevar enfermedades neurodegenerativas.Bibliografía:
- B
- Bóvedas
-
Las bóvedas son unos orgánulos citoplasmáticos presentes exclusivamente en las células eucariotas descubiertos recientemente, cuyo nombre se debe a su forma al mirarlas con el microscopio electrónico, similar a los arcos de las bóvedas de las catedrales.

En cuanto a su estructura, se tratan de partículas de ribonucleóproteínas unas tres veces más grandes que los ribosomas. Están formadas por la unión, creando una especie de barril, de dos complejos iguales formados por alrededor de 78 “proteínas de bóveda mayores” (MVP), una “proteína de bóveda menor”, y una pequeña cadena de ARN propio.


Su función aún no es comprendida del todo debido a su reciente descubrimiento en la década de los 80, pero se conoce su relación con los poros nucleares como complejos de soporte debido a su forma octogonal. Además se ha confirmado su función de transporte de moléculas, como por ejemplo del ARN mensajero desde el núcleo hasta el citoplasma donde será traducido, y también se piensa que podría tener algún papel en la síntesis de proteínas. Por otro lado, a pesar de que no se puede afirmar su función en este campo, si se puede pensar que tengan alguna relación con la resistencia a medicamentos en las células tumorales, ya que se ha observado una sobreexpresión de estos orgánulos en pacientes con cáncer a los que se les había diagnosticado multirresistencia.
Por otro lado, una “proteína de bóveda mayor” es una proteína, codificada en los humanos por un gen específico, que se encuentra relacionada con la resistencia a infecciones de pulmón, lo que puede reafirmar la relación de las bóvedas con el diagnóstico de multirresistencia en algunas personas. Además se han observado interacciones con el receptor de estrógeno alfa, lo cual podría indicar cierta relación con la transcripción del ADN, sobre todo teniendo en cuenta su directa relación con el ARNm y el posible papel de las bóvedas en la síntesis de proteínas.
 Proteína de bóveda mayor.
Proteína de bóveda mayor.En cuanto al ARNv presente en estos complejos, también ha sido estudiado, y se ha utilizado para diferentes aplicaciones, todas relacionadas con las funciones ya mencionadas. Para ampliar información puedes consultar esta entrada de Wikipedia: http://en.wikipedia.org/wiki/Vault_RNA#Biological_Applications
- BIBLIOGRAFÍA:
http://en.wikipedia.org/wiki/Vault_(organelle)
http://en.wikipedia.org/wiki/Major_vault_protein
http://www.nature.com/onc/journal/v22/n47/full/1206947a.html
- C
- Canales iónicos
- Los canales iónicos son estructuras protéicas que atraviesan las membranas formando un canal acuoso, y por el que pueden pasar los iones de un lado a otro de la membrana. Estos canales pueden encontrarse abiertos (dejan pasar los iones) o cerrados (no dejan pasar iones). También se pueden encontrar inactivados en el caso de que las proteínas del canal no puedan ser estimuladas por ningún elemento para abrirse. Este sistema permite la selección de iones a traspasar la membrana, como control, aunque pasan sin gasto alguno de energía cuando los canales se abren, gracias a la diferencia del gradiente electroquímico. Los canales iónicos se puede decir que forman parte del grupo del trasporte pasivo de sustancias a través de la membrana, pero cuyo tránsito es regulado por esta proteína transmembranal.
 Estas proteínas, que en reposo conforman un canal cerrado, se activan ante un cierto voltaje o su unión con un ligando, el cual al encajar permite a la proteína cambiar su conformación, dejando pasar a los iones durante unos instantes. Estos ligandos suelen ser neurotransmisores (como la adrenalina* o la acetilcolina).Vídeo explicativo de la diferencia entre la activación por voltaje y la del ligando.
Estas proteínas, que en reposo conforman un canal cerrado, se activan ante un cierto voltaje o su unión con un ligando, el cual al encajar permite a la proteína cambiar su conformación, dejando pasar a los iones durante unos instantes. Estos ligandos suelen ser neurotransmisores (como la adrenalina* o la acetilcolina).Vídeo explicativo de la diferencia entre la activación por voltaje y la del ligando.
*Como curiosidad: se dice que la adrenalina nos prepara para el peligro porque activa todos nuestros sentidos y músculos para una situación extrema. Esto es porque en estas situaciones se libera adrenalina ya que esta, como neurotransmisor, es capaz de abrir los canales iónicos y permitir la entrada de estos iones para acelerar su funcionamiento alterando la homeostasis. El trasporte de iones al interior celular permite alterar o estimular a la célula metabólicamente, por eso estos canales están muy presentes en células nerviosas, pues los iones influyen en la sinapsis neuronal, aunque también interfieren en actividades como el latido cardíaco o el funcionamiento de los túbulos renales. Algunas enfermedades relacionadas son: la miotonia (en células musculares), la fibrosis quística (relacionado con el sistema respiratorio), o el Síndrome de Prader-Willi (en el sistema nervioso).
El trasporte de iones al interior celular permite alterar o estimular a la célula metabólicamente, por eso estos canales están muy presentes en células nerviosas, pues los iones influyen en la sinapsis neuronal, aunque también interfieren en actividades como el latido cardíaco o el funcionamiento de los túbulos renales. Algunas enfermedades relacionadas son: la miotonia (en células musculares), la fibrosis quística (relacionado con el sistema respiratorio), o el Síndrome de Prader-Willi (en el sistema nervioso). Bibliografía:Bibliografía de las imágenes:http://reddesaludcanalesionicos.blogspot.com.es/2012/11/canales-ionicos-descripcion-los-canales.htmlhttp://ariasesteban.blogspot.com.es/2010/10/transporte-de-particulas-traves-de-la.htmlhttp://www.javeriana.edu.co/Facultades/Ciencias/neurobioquimica/libros/neurobioquimica/receptores.htm
Bibliografía:Bibliografía de las imágenes:http://reddesaludcanalesionicos.blogspot.com.es/2012/11/canales-ionicos-descripcion-los-canales.htmlhttp://ariasesteban.blogspot.com.es/2010/10/transporte-de-particulas-traves-de-la.htmlhttp://www.javeriana.edu.co/Facultades/Ciencias/neurobioquimica/libros/neurobioquimica/receptores.htm - Clatrina
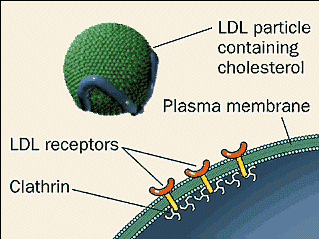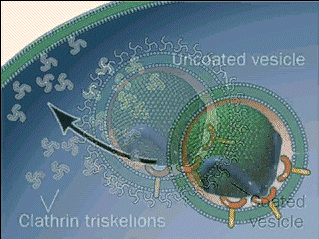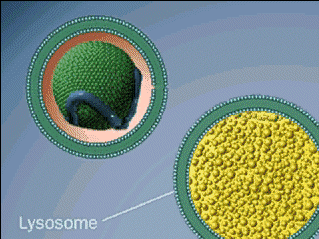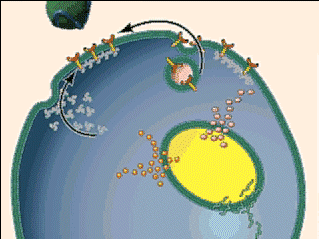
- Se trata de un complejo proteico que actúa como mediadora en el proceso celular de la endocitosis. En este proceso la célula introduce otras moléculas o partículas dentro de ella, rodeándolas con la membrana citoplasmática, formando una vesícula que acaba desprendiéndose de la membrana para incorporarse al citoplasma.
La clatrina consta de tres cadenas polipeptídicas grandes y tres ligeras. Estas juntas forman una esrtuctura llamada trisquelion, con forma de esqueleto en cesto convexo.


Elaboración de trisquelion por Clatrinas
Para llevar a cabo la endocitosis, proceso mencionado anteriormente, se utiliza este complejo proteico, la claritina, para hacer de mediadora. Este se fija a la membrana citoplasmática por medio de proteínas adaptadoras (complejo AP-2), interactuando con el complejo proteico a través de una subunidad. Así, se genera una malla de claritina que cubra toda la vesícula formada.
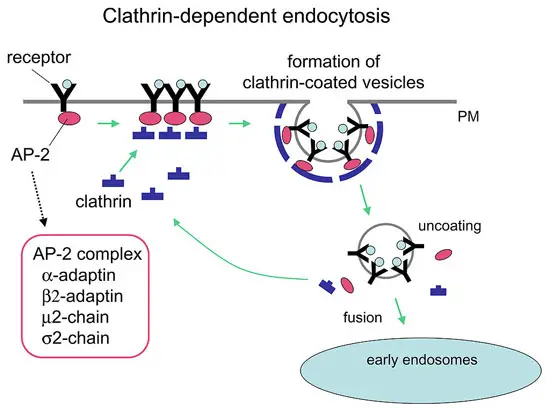
El cierre de la vesícula con la clatrina se controla por la GTPasa dinamina, la cual hidroliza al GTP para generar la fuerza necesaria para el cierre de la vesícula. Una vez la vesícula se desprende, la cubierta se pierde rápidamente, así como la clatrina.
A pesar de que las vesículas que se forman con la claritina son pequeñas y uniforme, esta también está implicada en la formación de vesículas grandes, como las vesículas de secreción (encargadas de almacenar, transportar o digerir preductor y residuos celulares y de la organización del metabolismo). En los casos de las vacuolas grandes, la clatrina forma parches para la aprición de una membrana doble, aunque el gran tamaño de la vesícula impide que estos “parches” cubran la membrana entera.
Para más información, vean este vídeo.
Webgrafía
- Complejo CRISPR/Cas
-
El complejo CRISPR/Cas, cuyo significado es Clustered Regularly Interspaced Short Palindromic Repeats en el primero término y donde el segundo se corresponde con un conjunto de proteínas, supone una revolución genética.
Igual que los vertebrados y otros organismos que presentan un sistema inmune desarrollado, podríamos afirmar que las bacterias, a pesar de ser organismos unicelulares también cuentan con su sistema inmune, al que llamamos CRISPR/Cas. Esto es posible ya que las bacterias pueden ser infectadas por fagos, lo que se produce de la siguiente forma:

Las bacterias presentan un sistema de restricción/modificación para eliminar los virus que infectan bacterias pero el complejo CRISPR/Cas es otra alternativa. Puede ocurrir que el bacteriófago interaccione con dicho complejo, donde CRISPR señala el ADN extraño y Cas corta este ADN, resultando inactivado y destruido. Estas secuencias repetidas o CRISPR, idénticas a fragmentos de ADN del bacteriófago, se transforman en ARN y se asocian a las nucleasas Cas9 que lo cortan. Cuando el virus infecta a la bacteria, el complejo lo reconoce y actúa. Además, estas proteínas Cas pueden transformar el material genético del virus e introducirlo en el complejo CRISPR, lo que permite una mejor defensa para futuras invasiones.
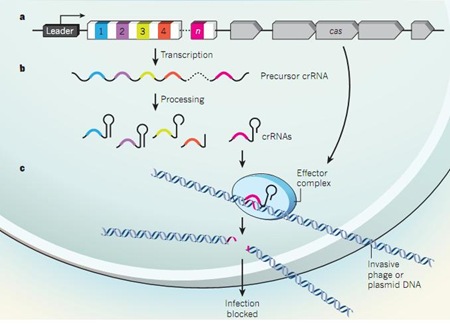
Se trata de gran descubrimiento ya que nos permitiría introducir cualquier tipo de material genético en cualquier ser vivo y así poder tratar numerosas enfermedades.
Vídeo explicativo: https://www.youtube.com/watch?v=2pp17E4E-O8
Para saber más: http://www.uam.es/personal_pdi/ciencias/jmsierra/documents/ResumenJorgeVal11-12.pdf
Webgrafía:
http://curiosidadesdelamicrobiologia.blogspot.com.es/2014/05/la-revolucion-crisprcas.html
http://bacteriasactuaciencia.blogspot.com.es/2014/06/crispr-cas-la-revolucion-genetica-que.html
http://elcomercio.pe/blog/expresiongenetica/2014/12/edicion-adn-nueva-era-medicina
María Montero Lázaro
- Complejo RISC
- El complejo RISC, es un complejo de silenciamiento de genes, de naturaleza ribonucleoprotéica. La función de este complejo es separar las dos hebras del ARN de interferencia (ARNi) de manera que mantiene unida la cadena antisentido (no codificante) y así pueda producirse la unión a la cadena sentido (codificante) del ARN mensajero diana. Si al producirse el reconocimiento y la unión de ambas cadenas, existe complementariedad, el complejo RISC degrada el ARN mensajero inhibiéndose la síntesis de proteína. Este proceso tiene lugar en el citoplasma celular, pero en ocasiones el complejo unido al ARNi puede entrar en el núcleo alterando la expresión génica al producirse la metilación del ADN y de las histonas provocando el silenciamiento antes de que ocurra la transcripción.
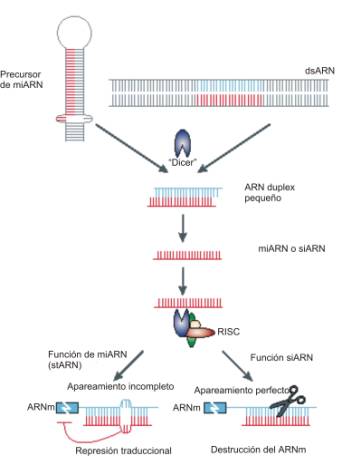 Webgrafía
Webgrafía
- D
- Desmosoma
- Son estructuras celulares que se mantienen adheridas a células vecinas. Su función es mantener unidas a las células del epitelio, asociando los citoesqueletos de filamentos intermedios de las células vecinas. Así forman una red transcelular con una alta resistencia a la tracción mecánica, permitiendo que las células mantengan su forma.

Estas uniones tienen la forma de un botón (mácula) y se ubican en zonas de los límites intercelulares.
Las membranas de las células adyacentes son paralelas entre sí, separadas por un espacio de unos 20 nm, el cual presenta una línea densa en su zona media. Además posee una gruesa banda llamada placa desmosómica, la cual se encuentra adherida a la cara intracelular de la membrana plasmática, y numerosos filamentos intermedios insertos en ella. El espacio entre las membranas adyacentes contiene a los dominios extracelulares de las glicoproteínas transmembrana de la familia de las caderinas (representadas en el dibujo anterior mediante pequeños cilindros verdes), llamadas desmogleínas y desmocolinas (el dominio citoplasmático de ambas se ubica en la placa desmosómica, donde se unen a proteínas intracelulares). Mediante la interacción entre las caderinas que se enfrentan, ocurre la unión en el extracelular de las dos células adyacentes. La mantención de la interacción entre las caderinas depende de la presencia de Ca++.Foto microscópica:
El espacio entre las membranas adyacentes contiene a los dominios extracelulares de las glicoproteínas transmembrana de la familia de las caderinas (representadas en el dibujo anterior mediante pequeños cilindros verdes), llamadas desmogleínas y desmocolinas (el dominio citoplasmático de ambas se ubica en la placa desmosómica, donde se unen a proteínas intracelulares). Mediante la interacción entre las caderinas que se enfrentan, ocurre la unión en el extracelular de las dos células adyacentes. La mantención de la interacción entre las caderinas depende de la presencia de Ca++.Foto microscópica: En el siguiente vídeo se habla de los diferentes tipos de uniones, siendo una de ellas los desmosomas:https://www.youtube.com/watch?v=4uxDYOpp8NIY en el siguiente se explica de forma más profunda, las características y funciones de la caderina:https://www.youtube.com/watch?v=suWJK60jGr0Bibliografía:http://es.wikipedia.org/wiki/Desmosomahttp://escuela.med.puc.cl/paginas/cursos/segundo/histologia/histologiaweb/paginas/ep11945.htmlhttp://www.uv.es/derma/CLindex/CLampollosas/desmo1.htm
En el siguiente vídeo se habla de los diferentes tipos de uniones, siendo una de ellas los desmosomas:https://www.youtube.com/watch?v=4uxDYOpp8NIY en el siguiente se explica de forma más profunda, las características y funciones de la caderina:https://www.youtube.com/watch?v=suWJK60jGr0Bibliografía:http://es.wikipedia.org/wiki/Desmosomahttp://escuela.med.puc.cl/paginas/cursos/segundo/histologia/histologiaweb/paginas/ep11945.htmlhttp://www.uv.es/derma/CLindex/CLampollosas/desmo1.htm
- E
- Endosimbiosis
- La teoría endosimbiótica fue postulada por Lynn Margulis en 1967 en su obra On the origin of mitosing cells y posteriormente completada en obras posteriores. Esta teoría plantea que ciertos orgánulos de células eucariotas, especialmente las mitocondrias y los cloroplastos, son el resultado de años de evolución iniciados por la endocitosis de un organismo procariota. Según esta teoría, dicho organismo no fue digerido, sino que comenzaron una relación de simbiosis.
 Las mitocondrias y los cloroplastos tienen algunas similitudes con células bacterianas. Tienen su propio ADN que está separado del ADN nuclear. Cada uno de estos orgánulos usa su propia ADN para fabricar proteínas. También una doble membrana recubre ambos orgánulos y se reproducen como las bacterias, replicando su propio ADN y dirigiendo su propia división.José Ángel Beloqui
Las mitocondrias y los cloroplastos tienen algunas similitudes con células bacterianas. Tienen su propio ADN que está separado del ADN nuclear. Cada uno de estos orgánulos usa su propia ADN para fabricar proteínas. También una doble membrana recubre ambos orgánulos y se reproducen como las bacterias, replicando su propio ADN y dirigiendo su propia división.José Ángel Beloqui - Espliceosoma
- Los espliceosomas son complejos formados de ribonucleoproteínas snRNPs. Se componen de cinco ARN nucleares pequeños,ricos en uracilo, y complejos protéicos asociados. Son necesarios en los procesos de corte y empalme del ARNm para eliminar los intrones ( secuencias no codificantes) y ligar solo los exones flanqueantes (secuencias codificantes). El espliceosoma sigue una serie de pasos de empalme que son:1- El extremo 5´ del intrón se une a otro sitio interno del intrón cercano a su extremo 3´(sitio de ramificación).2- Se realiza el corte en el extremo 3´del intrón para poder empalmar los dos exones esto provoca que se libere el ARN maduro del espliceosoma.3- El intrón eliminado con forma de lazo(lariat)se degrada en el núcleo.
El proceso que llevan a cabo se conoce como splicing. Este es un proceso pos-transcripcional que ayuda a la maduración del ARN. Bibliografía.http://www.botanica.cnba.uba.ar/Pakete/Dibulgeneral/Splicing/Splicing.htmhttp://es.wikipedia.org/wiki/Splicing_de_ARNhttp://www.cun.es/diccionario-medico/terminos/espliceosoma
Bibliografía.http://www.botanica.cnba.uba.ar/Pakete/Dibulgeneral/Splicing/Splicing.htmhttp://es.wikipedia.org/wiki/Splicing_de_ARNhttp://www.cun.es/diccionario-medico/terminos/espliceosoma - Exosoma
- El complejo exosoma o también llamado complejo PM/Scl, se tratan de pequeñas vesículas secretadas por la célula, formado por un grupo de dos o más proteínas, encargadas de degradar diversos tipos de ARNs, actuando como mensajeros. En el interior de estas vesículas podemos encontrar lípidos, ARN mensajero y proteínas, las cuales viajan de unas células a otras por el tejido del cuerpo llevando información específica.Están presentes en células eucariotas y arqueobacterias, pero también podemos encontrarlo en las bacterias, pero llamado de diferente manera, degradasoma, el cual cumple funciones similares al citado anteriormente.
 Al encontrarse en todos los fluidos y su gran potencial como marcador biológico de enfermedades, se está invirtiendo en diagnósticos de los exosomas para enfermedades como el cáncer, VIH, tuberculosis
Al encontrarse en todos los fluidos y su gran potencial como marcador biológico de enfermedades, se está invirtiendo en diagnósticos de los exosomas para enfermedades como el cáncer, VIH, tuberculosis Pero también llama la atención que el complejo exosoma se trate de un antígeno autoanticuerpos los cuales son responsables de las enfermedades autoinmunesWebgrafía:http://www.divulgades.es/exosomas/http://es.wikipedia.org/wiki/Complejo_exosoma#Patolog.C3.ADahttp://www.biounalm.com/2011/03/uso-potencial-de-los-exosomas-para-el.html (utilización de los exosomas para una enfermedad concreta: Alzheimer)
Pero también llama la atención que el complejo exosoma se trate de un antígeno autoanticuerpos los cuales son responsables de las enfermedades autoinmunesWebgrafía:http://www.divulgades.es/exosomas/http://es.wikipedia.org/wiki/Complejo_exosoma#Patolog.C3.ADahttp://www.biounalm.com/2011/03/uso-potencial-de-los-exosomas-para-el.html (utilización de los exosomas para una enfermedad concreta: Alzheimer)
- F
- Fotosistemas
-
Los fotosistemas son unidades que forman parte de la fotosíntesis en la fase luminosa, y dicha fase sucede en los tilacoides del cloroplasto, o también llamado grana, que es un conjunto de estos. Los fotosistemas se encuentran en el cuantosoma(membrana del tilacoide), al igual que la cadena transportadora de electrones.
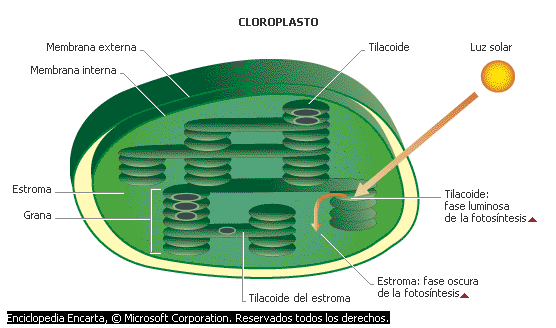
Hay dos fotosistemas: fotosistema I y fotosistema II. Y cada uno de ellos se componen de un complejo de antena (formado de clorofila) y centro de reacción (idem). Las diferencias de los fotosistemas se observa en la etapas de la fase luminosa.
Las etapas son:
-
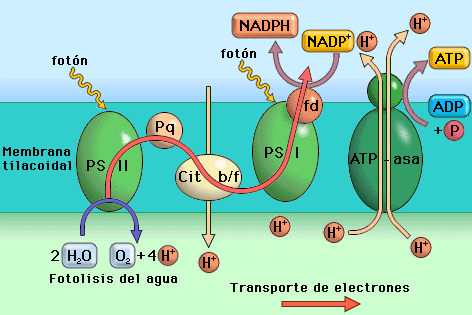
Fotoexitación: en el fotosistema II se recibe la luz en forma de partículas (fotones) por el complejo antena. Esta transmite la energía hasta el centro de reacción y libera dos electrones, los cuales son recibidas por la cadena de electrones. Lo mismo ocurre con el fotosistema I.
-
Fotorreducción: en el final de la cadena de electrones del fotosistema I, los electrones se transmite a NAD(NADP--> NAPH), donde se reduce la molécula(se carga de electrones).
-
Fotolisis del agua: entonces, como hay una carencia de electrones del fotosistema I, recibe otros dos electrones de la cadena de electrones del fotosistema II(se reemplazan). Y los electrones del fotosistema II se reemplazan con el agua. Para obtener dos electrones del H2O, esta se rompe: H2O------>2H+ +1/2O2 + 2H-
-
Fotofosforilación: al pasar los electrones por la cadena de electrones del fotosistema II, pasa por el citocromo B6F(Cyt B6F), la cual bombea protones para formar ATP: ADP+P--->ATP
Bibliografía
http://es.wikipedia.org/wiki/Fotosistema
http://almez.pntic.mec.es/~jrem0000/dpbg/Fotosintesis/fotosistemas.html
http://www.biologia.arizona.edu/biochemistry/problem_sets/photosynthesis_1/11t.html
https://www.youtube.com/watch?v=9sKq7hS19o0
-
- G
- Glioxisomas
-
Los glioxisomas son orgánulos membranosos caracteristicos de las células eucariotas de tipo vegetal , son un tipo especializado de los peroxisomas ( orgánulos del citoplasma muy comunes en forma de vesículas que contienen enzimas como la oxidasa y la catalasa) que transforman los lípidos en carbohidratos durante la germinación de las semillas. Además contienen las enzimas clave del ciclo del glioxilato, estas enzimas son la isocitrato liasa y la malato sintasa. Así realizan la ruptura de los ácidos grasos y producen los productos intermedios para la síntesis de azúcares por gluconeogénesis. La gluconeogénesis es un proceso por el cual se forman nuevas glucosa a partir de sustancias que no son hidratos de carbono. Es una ruta metabólica anabólica que permite la biosíntesis de glucosa a partir de precursores no glucídicos.
Estructura de glioxisoma:
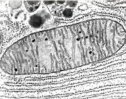
Ciclo del glioxilato:
Permite generar glucosa a partir de ácidos grasos, esto es muy importante en las semillas, debido a que la mayor parte de la energía metabólica necesaria para su desarrollo se encuentra en forma de triacilgilceroles.
Podemos ver el proceso en la imagen siguiente:

WEBGRAFÍA
http://es.scribd.com/doc/42204712/Ciclo-Del-Glioxilato#scribd
http://es.slideshare.net/luisrames/lisosomas-peroxisomas-glioxisomas-ribosomas-15136701
ENCICLOPEDIAS BIOLOGÍA 2000 BLOQUE II
Para una mejor comprensión del ciclo:
Ciclo del Glioxilato: http://youtu.be/cfZ1783_T48
- H
- Herencia mitocondrial
-
Sabemos que el ADN, con sus caracteres y sus mutaciones es transferido de ambos progenitores a todos los descendientes por los cromosomas del núcleo celular. Pero las mitocondrias, el orgánulo celular encargado de producir energía para la célula, también posee ADN (llamado ADN mitocondrial) y cuando estudiamos su transmisión, hablamos de herencia mitocondrial. El ADN mitocondrial tiene la característica de que sus genes sólo son transferidos por el sexo femenino, por lo tanto, un varón con tales genes (transferidos por su madre) jamás los transmitirá a sus descendientes.

Debido a que la tasa de mutación del genoma mitocondrial es 10 veces más alta que la del genoma nuclear, existen múltiples trastornos y fenotipos asociados a este tipo de herencia. Un ejemplo de mutación y trastorno es la pérdida auditiva originada en hipersensibilidad a los aminoglicósidos.
“El fenotipo de esa hipersensibilidad es el resultado de una simple transición de la base A a la G en la posición 1555 en el rRNA mitocondrial 12S(...). Cuando un aminoglicósido como la estreptomicina se administra a pacientes que llevan esta mutación, se une al mutante 12S rRNA e impide su funcionamiento en el traslado de los genes mitocondriales.” - Dr. Enrique Moren (2009). Herencia Mitocondrial. [ONLINE] Available at: https://audiology.wordpress.com/genetica-molecular-en-otologia/mutaciones-del-genoma-mitocondrial/herencia-mitocondrial/. [Last Accessed 21 January 15].
Webgrafía
- I
- J
- K
- L
- Lisosomas
-
Los lisosomas son orgánulos esféricos, están localizados en el citoplasma y su función es realizar la digestión celular.
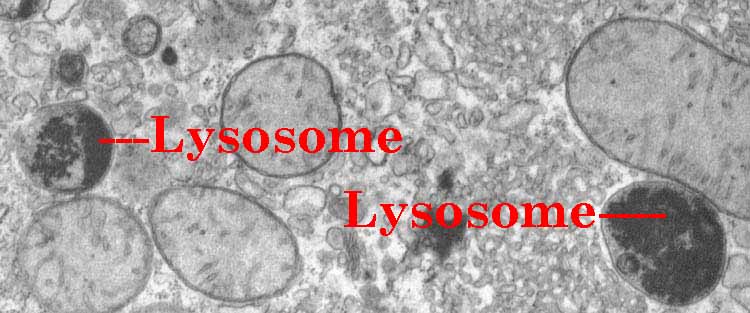 Su estructura está formada fundamentalmente por una membrana plasmática que protege las enzimas de su interior (hidrolasas ácidas- descomponen los polímeros en monómeros).
Su estructura está formada fundamentalmente por una membrana plasmática que protege las enzimas de su interior (hidrolasas ácidas- descomponen los polímeros en monómeros).
La cara interna de esta membrana está muy glucosilada (contiene glucosa) para evitar la autodigestión.
Los lisosomas mantienen un pH de 5 en su interior, esencial para mantener activas sus enzimas y así llevar a cabo su función. Hay dos tipos de lisosomas:
Hay dos tipos de lisosomas:
-Primarios: procedentes del aparato de Golgi.
-Secundarios: procedentes de la fusión de varios lisosomas primarios. En ellos tiene lugar la digestión celular. Los restos de este proceso que no pueden ser aprovechados por la célula, deben ser excretados al exterior
Los lisosomas son muy diferentes tanto en contenido como en forma en función del tipo de célula en la que se encuentran.
Las enfermedades más características son la Gota, que consiste en cristales de ácido úrico provenientes del catabolismo de las purinas en las articulaciones.
Y la Artritis reumatoide que causa la destrucción de las membranas lisosomales y la liberación de enzimas y la lisis celular.VIDEO http://youtu.be/Q4Kzdfk_Lr8
Apuntes de la asignatura Biología celular e histología humana. Grado en fisioterapia.
http://recursos.cnice.mec.es/biosfera/alumno/2bachillerato/La_celula/contenidos11.htm
http://es.wikipedia.org/wiki/Lisosoma#Enfermedades_lisos.C3.B3micas
- M
- Microfillamentos
-

Los microfilamentos constituyen uno de los componentes del citoesqueleto, orgánulo que sólo aparece en células eucariotas. Se forman por la polimerización de proteínas beta actina, las cuales aparecen en la mayoría de las células animales, y alfa actina, que abundan en el músculo.
En cuanto a su forma podemos decir que estos filamentos de actina presentan aproximadamente de 3 a 7 nm de diámetro, constituyendo así los filamentos más pequeños y flexibles del citoesqueleto. En ellos las moléculas de actina se disponen de forma helicoidal y presentan un extremo más y otro menos, es decir, una estructura polarizada.
Desempeñan diversas funciones como aporte de soporte a la célula, formación de pseudópodos, movimientos celulares, incluyendo desplazamiento, ciclosis (corrientes citoplasmáicas en las que se produce el movimiento de los orgánulos) contracción y citocinesis, ya que forman el anillo contráctil que produce el estrangulamiento en las células animales, permitiendo la separación de las células hijas. Además la asociación de los microfilamentos con otras moléculas, como la miosina, es la responsable de la contracción muscular.
En las células animales se encuentran normalmente localizados cerca de la membrana plasmática, en la denominada corteza celular, aunque también aparecen en zonas más internas de la célula, y gracias a esta localización pueden participar en procesos de endocitosis y fagocitosis.También podemos observar estos microfilamentos en las denominadas microvellosidades, en cuya base aparece un eje de filamentos de actina.
A continuación se muestran un vídeo y una imagen que explican más detenidamente y nos permiten visualizar la formación de un filamento de actina:
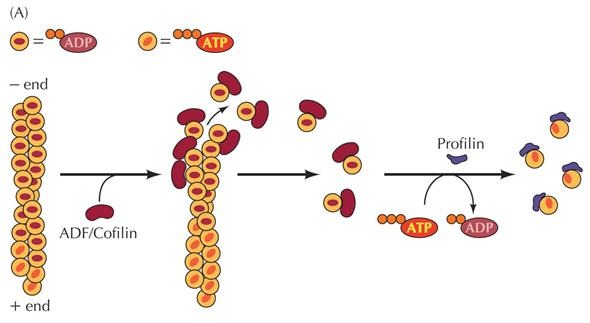
Bibliografía:
http://webs.uvigo.es/mmegias/5-celulas/7-actina.php
http://www.biologia.arizona.edu/cell/tutor/cyto/page1.html
http://www.elergonomista.com/biologiaselectividad/sb68.html
http://www.ua.es/personal/guti/Tema/nomenbranosos.htm
- N
- Ñ
- O
- P
- Péptido señal
-
Se trata de un péptido señal a la combinación comprendida desde unos tres hasta sesenta aminoácidos colocados en un orden característico, que marcan la proteína y la dirigen a cierto orgánulos como el núcleo, el retículo endoplasmático, la matriz mitocondrial, los cloroplastos... Está presente en el extremo N-terminal de muchas proteínas recién sintetizadas y decide sobre el destino, la ruta de transporte y la eficiencia de secreción de la proteína (cenaseis). Son heterogéneos e intercambiables.
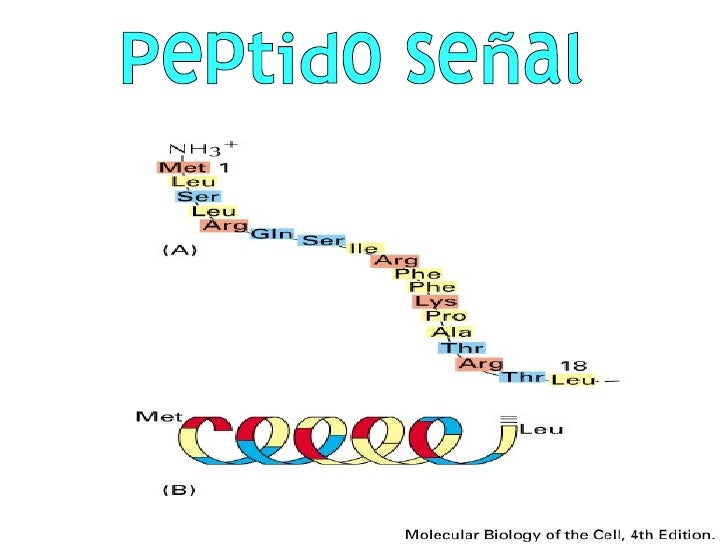
En su conjunto, está formado por aminoácidos hidrófobos que forman una hélice alfa. Está dividido en tres partes: la n-región, la h-región y la c-región. En la n-región se encuentran los aminoácidos con carga positiva o negativa, los cuales pueden servir de ayuda para hacer cumplir topología adecuada durante la translocación, y la h-región es una parte hidrófoba. Por otro lado, en la c-región, en la parte final del péptido se encuentra el sitio de reconocimiento por la peptidasa señal.
Existen al menos dos tipos de clasificación en las proteínas: uno de ellos se encuentra en una región continua de la secuencia de aminoácidos, el cual la mayoría de las veces es eliminado por una peptidasa señal especializada; por otro lado, encontramos otro tipo de señal que consiste en una disposición tridimensional característica de átomos de la superficie de las proteínas, el cual se forma al plegarse la proteína.
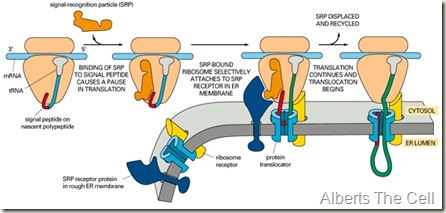
La peptidasa señal aparece durante o después de la translocación para formar un péptido señal libre, el cual se dirige a las proteasas específicas, y una proteína madura.
La translocación en procariotas es un proceso que se caracteriza por la conducción de una proteína recién sintetizada a partir de un péptido señal en un canal de conducción presente en la membrana plasmática. En eucariotas, en cambio, ocurre el mismo proceso pero en un canal del retículo endoplasmático. Por lo tanto la transición por estos dos canales se conoce como translocación.
WEBS:
http://es.wikipedia.org/wiki/P%C3%A9ptido_se%C3%B1al
http://campodocs.com/articulos-para-saber-mas/article_54745.html
- Proteosoma
-
Se trata de complejos proteicos grandes compuestos por dos complejos estructurales diferentes que a su vez se componen de subunidades proteicas. Están presentes en las células eucariotas y en algunas bacterias en el núcleo y en el citoplasma.
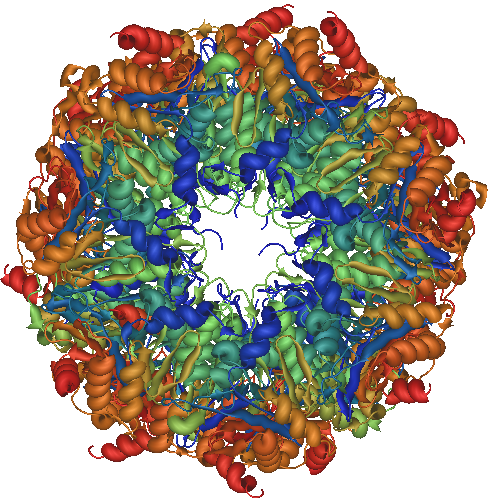

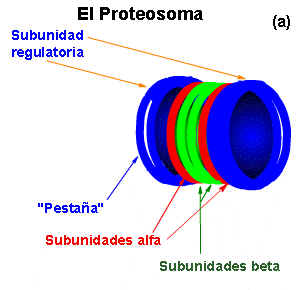
Sus principales funciones son: degradación de proteínas de forma selectiva, diferenciación celular, contribuyen en el sistema inmunológico por medio del inmunoproteosoma, regulan el ciclo celular y actúan como defensa contra toxinas.
Existen tres tipos de proteosomas: el proteosoma 26S, el 30S y el inmunoproteosoma. Su diferenciación radica en la subunidad reguladora y en el número de estas.
El proceso de degradación de proteínas comienza con el marcaje de la proteína con ubiquitina. Mediante esta señal, los proteosomas irán a la proteína y la desplegarán para degradarla en su interior. El producto que sale de esta degradación son aminoácidos en forma de oligopéptidos.
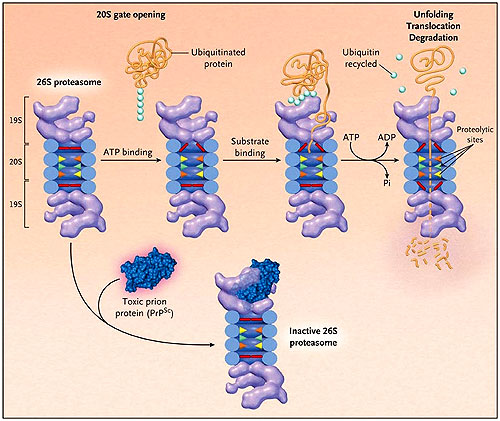
En esta animación se puede observar el proceso de degradación de proteínas que ocurre en los proteosomas: animación
Las enfermedades asociadas a este complejo se dividen en dos categorías: por inhibición o mal funcionamiento de proteosomas (párkinson, enfermedad de Huntington, ataxias, alzhéimer) o por la sobreexpresión de los mismos (cáncer).
Webgrafía:
- Q
- R
- S
- T
- Transposones
- Los transposones, también conocidos como genes saltarines son secuencias de ADN capaces de moverse a diferentes partes del genoma de una célula. Fueron descubiertos y estudiados en los años cuarenta y cincuenta por Barbara McClintock, galardonada con el premio Nobel en 1983 por ello.
 Barbara McClintock (1902-1992)
Barbara McClintock (1902-1992) Los transposones se clasifican de diversa manera: según su contenido (simple o compuesto), según el mecanismo de transposición (conservativa o semiconservativa); o la más común, según la estrategia de transposición: diferenciando entre los transposones de clase 1, aquellos que necesitan de una transcriptasa inversa, o de clase 2 sin necesidad de lo anterior. Los transposones clase 2, pueden codificar para proteínas, por ejemplo, para la transposasa requerida para moverse y adherirse a otro locus del genoma, este proceso se denomina “corta y pega”. Para poder ser reconocidos por la transposasa, estos transposones están flanqueados por un conjunto de 9 a 40 pares de bases invertidas y repetidas a ambos lados (de tal manera que si hubiese en el extremo 3’ de la cadena superior la secuencia AGGGTC, en el extremo 3’ de la cadena inferior, este sería repetido, o parecido). Los transposones de clase 2, son muy poco abundantes. Por otro lado, los transposones clase 1, también conocidos como retrotransposones, necesitan de una fase intermediaria en forma de ARN, a partir de la cual, por medio de una retrotranscriptasa inversa, vuelve a forma de ADN, y se integran en un nuevo locus.
Los transposones se clasifican de diversa manera: según su contenido (simple o compuesto), según el mecanismo de transposición (conservativa o semiconservativa); o la más común, según la estrategia de transposición: diferenciando entre los transposones de clase 1, aquellos que necesitan de una transcriptasa inversa, o de clase 2 sin necesidad de lo anterior. Los transposones clase 2, pueden codificar para proteínas, por ejemplo, para la transposasa requerida para moverse y adherirse a otro locus del genoma, este proceso se denomina “corta y pega”. Para poder ser reconocidos por la transposasa, estos transposones están flanqueados por un conjunto de 9 a 40 pares de bases invertidas y repetidas a ambos lados (de tal manera que si hubiese en el extremo 3’ de la cadena superior la secuencia AGGGTC, en el extremo 3’ de la cadena inferior, este sería repetido, o parecido). Los transposones de clase 2, son muy poco abundantes. Por otro lado, los transposones clase 1, también conocidos como retrotransposones, necesitan de una fase intermediaria en forma de ARN, a partir de la cual, por medio de una retrotranscriptasa inversa, vuelve a forma de ADN, y se integran en un nuevo locus. Estos transposones se estima que ocupan alrededor de 50% del ADN humano, lo que provoca la aparición de enfermedades o alteraciones genéticas dependiendo del lugar en el que se inserten, ya que pueden alterar la zona de ADN que sintetiza para una determinada proteína, lo cual ha salido a la luz gracias a experimentos que han demostrado la presencia de transposones causantes de hemofilia, así como en algunos enfermos de cáncer de colón. Sin embargo, no todos los transposones causan desórdenes, es más, en algunos casos, son capaces de sintetizar sus propios silenciadores, como el ARN de interferencia, el cual hace inactivo determinados retrotransposones perjudiciales para la salud. Por otro lado, los transposones también son los responsables de la regulación génica y de la evolución del genoma, permitiendo unir exones que de otra manera estarían separados, y reparar los daños en la doble cadena de ADN.
Estos transposones se estima que ocupan alrededor de 50% del ADN humano, lo que provoca la aparición de enfermedades o alteraciones genéticas dependiendo del lugar en el que se inserten, ya que pueden alterar la zona de ADN que sintetiza para una determinada proteína, lo cual ha salido a la luz gracias a experimentos que han demostrado la presencia de transposones causantes de hemofilia, así como en algunos enfermos de cáncer de colón. Sin embargo, no todos los transposones causan desórdenes, es más, en algunos casos, son capaces de sintetizar sus propios silenciadores, como el ARN de interferencia, el cual hace inactivo determinados retrotransposones perjudiciales para la salud. Por otro lado, los transposones también son los responsables de la regulación génica y de la evolución del genoma, permitiendo unir exones que de otra manera estarían separados, y reparar los daños en la doble cadena de ADN.
- U
- Uniones GAP
-
Las uniones gap, también conocidas como uniones eléctricas, uniones en hendidura o uniones comunicantes, son aquellas conexiones que se encuentran entre las células de los tejidos animales. Concretamente, son canales que comunican el citoplasma de células adyacentes.

Cada uno de los canales está formado por dos hemicanales alineados, los cuales están compuestos por seis proteínas denominadas conexinas, las cuales se desplazan unas respecto a otras para propiciar la apertura del poro del canal. Requieren que el espacio intersticial entre las membranas de las células se reduzca desde los 25 nm normales hasta los 2 nm. Cada conexión puede darse mediante un solo tipo de conexina (homomérico) o por la presencia de múltiples clases de conexinas (heteromérico).
La razón por la que estas uniones también se denominan eléctricas reside en que también permiten el paso de la conexión eléctrica entre las células, en concreto de iones, favoreciendo la sinapsis eléctrica y sin necesidad de un mensajero químico. Esto produce que la transmisión del impulso nervioso sea bidireccional y más rápida, ya que, incluso, se reduce la resistencia al paso de los iones.
Los principales estímulos que producen el cierre de las uniones gap son la disminución del Ph, el aumento de la concentración de Ca++ y el crecimiento en el número de plaquetas y de la epidermis.
Las uniones gap se hallan en todos los tipos de tejidos animales, excepto en las células móviles como los espermatozoides, destacando principalmente el tejido muscular y el epitelial.

Vídeo (canales conectores):
Bibliografía:
http://biologiamedica.blogspot.com.es/2010/09/contraccion-del-musculo-cardiaco-las.html
http://es.slideshare.net/PiaHurtadoBurgos/uniones-celulares-13071026
https://es.scribd.com/doc/67861545/Las-Uniones-GAP
Marina Robleño Vélez
- V
- W
- X
- Y
- Z
- Zonula adherens
- En castellano se conoce como Unión intermedia y se localiza inmediatamente de la Zonula occludens, o Uniones oclusivas, separándose estas dos membranas 15-20 nm la una de la otra.
Se trata de un área continua que cubre toda la capa exterior de la célula y que a la vez genera un espacio intercelular. Esto permite que las células se anclen entre ellas ya que este área contiene material filamentoso denso, es decir, contiene proteínas transmembranosas (cadherinas) que a su vez reaccionan con microfilamentos intracelulares, como la actina, por medio de una proteína de unión. Los filamentos de actina que están relacionados con las uniones adherentes forman la barra terminal de la célula.Los filamentos de actina que están relacionados con las uniones adherentes forman la barra terminal de la célula.Este área está compuesto de tres elementos principales:1.- Un domino de la membrana que contiene las cadherinas (glucoproteínas) haciendo que su adhesión dependa de los iones de calcio.2.- Una placa citosólica submembranal la cual posee una variedad de proteínas que permiten que las cadherinas puedan unirse al citoesqueleto de la actina.3.- Un haz de microfilamentos contráctiles de actina aunque son incompletos.
Los filamentos de actina que están relacionados con las uniones adherentes forman la barra terminal de la célula.Los filamentos de actina que están relacionados con las uniones adherentes forman la barra terminal de la célula.Este área está compuesto de tres elementos principales:1.- Un domino de la membrana que contiene las cadherinas (glucoproteínas) haciendo que su adhesión dependa de los iones de calcio.2.- Una placa citosólica submembranal la cual posee una variedad de proteínas que permiten que las cadherinas puedan unirse al citoesqueleto de la actina.3.- Un haz de microfilamentos contráctiles de actina aunque son incompletos. Por otro lado también se observan dos roles principales en las zonas intermedias de las capas:1.- En una célula epitelial participa en el mantenimiento de la forma celular.2.- En el desarrollo embrionario temprano intervienen en la deformación de epitelios.BIBLIOGRAFÍA:
Por otro lado también se observan dos roles principales en las zonas intermedias de las capas:1.- En una célula epitelial participa en el mantenimiento de la forma celular.2.- En el desarrollo embrionario temprano intervienen en la deformación de epitelios.BIBLIOGRAFÍA: - Zonula occludens
-
Las células se anclan y se comunican con la matriz extracelular y con otras células mediante proteínas especializadas. A veces las uniones son más especiales y están más desarrolladas, formando estructuras macromoleculares llamadas complejos de unión que cierran y obstruyen el espacio intercelular. Estas uniones son fundamentales para mantener la cohesión entre tejidos, principalmente entre lo epitelios, el tejido nervioso y el muscular.
Hay varios tipos de uniones: uniones estrechas, uniones adherentes, desmosomas, hemidesmosomas y uniones focales. Las uniones estrechas o zonula occludens se dan entre células tan próximas que casi no hay espacio entre sus membranas plasmáticas, limitando la entrada de sustancias solubles extracelulares por difusión.
Las zonula occludens están formadas por ocludinas* y unas proteínas trasnmembranosas llamadas claudinas que establecen contacto entre las células. Las claudinas* formas poros (1nm de diámetro) que dejan pasar determinados iones desde el exterior de la célula. Según el tipo de claudina que sea (existen veinte tipos) se forma un poro diferente que permite a los epitelios variar su permeabilidad.


Estos complejos de unión se encuentran los extremos del tejido muscular cardiaco y los epitelios. En el caso de las células epiteliales las zonula occludens rodean todo el perímetro celular. Además de formar fuertes uniones entre las células, tienen otras funciones. Por ejemplo, en las células epiteliales digestivas evitan que las sustancias del interior del tubo digestivo entre en el organismo por los espacios situados entre las células. A su vez, permiten la polaridad de las células epiteliales ya que actúan como una barrera física para la difusión de las moléculas de la membrana plasmática. Esta polaridad permite establecer dos caminos diferentes, uno de captación y otro de liberación de las sustancias desde el medio extracelular al medio intracelular.
Animación de interés (en inglés):
*Glosario:
- Ocludina: proteína transmembranosa que une el espacio intercelular.
- Claudina: proteína integral de membrana presente en la función de las uniones estrechas. Son más importartes que las ocludinas.
Webgrafía:
http://es.wikipedia.org/wiki/Zonula_occludens
http://webs.uvigo.es/mmegias/5-celulas/2-complejos.php
