Historia y tecnología del buceo. Fisiología y adaptaciones
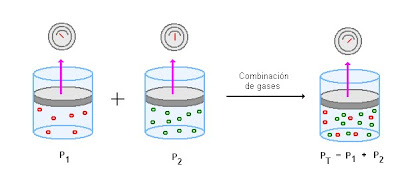
Ley de Dalton
LEY DE DALTON
En 1793 John Dalton publicó su obra Observaciones y ensayos meteorológicos. Y entre otras aportaciones, relacionó la presión de una mezcla de gases con la presión de cada uno de ello mediante la ley que enunció, la cual decía que en una cierta mezcla de gases que no reaccionan químicamente, la presión que ejerce cada uno de los gases es la misma que ejercería si ocupase independientemente el mismo volumen a la misma temperatura.33

Fuente imagen: https://apunteshenry.wordpress.com/2010/01/09/ley-de-dalton-presiones-parciales/
De esta forma podemos denominar presión parcial de un gas a la presión que ejerce cada gas por separado, en el mismo volumen y a la misma temperatura. De este modo a la presión de la mezcla se le denominaría presión total. De este modo podemos conocer a qué profundidad un determinado gas contenido en el aire puede provocar efectos nocivos en nuestra salud mientras buceamos.34
Fuente imagen: http://estquimica.blogspot.com.es/p/esta-ley-establece-como-enunciado-la.html

Fuente imagen: https://fisgoncientifico.wordpress.com/2015/07/19/si-lo-que-quieres-es-bucear-por-la-fisica-debes-comenzar/
Y entonces ¿por qué es importante esta ley en el buceo? Pues bien la respuesta reside en el efecto tóxico del oxígeno puro a 2 atmósferas de presión aproximadamente, por lo que la prioridad para un buceador es no sumergirse a una profundidad donde el propio oxígeno sea tóxico. Así, podemos concluir que para que el oxígeno sea tóxico, el aire contenido, debe estar sumergido a una presión media de unas nueve atmósferas y media, (en la superficie existe una atmósfera de presión), y que cada diez metros de profundidad, se suma una atmósfera más, por lo que el oxígeno será tóxico a unos 85 metros de profundidad. 35