TEMA -7- CARACTERÍSTICAS Y COMPOSICIÓN DE LOS SSVV
MONOSACÁRIDOS
1º MONOSACÁRIDOS
PROPIEDADES GENERALES
Los monosacáridos están formados por esqueletos de C en los que casi todos los C, menos uno, poseen una función alcohol (-OH, radical denominado hidroxilo) y, uno de los C posee un grupo aldehído (-CHO) a los que se denomina aldosa o un grupo cetona (C=O), denominándoseles cetosas.
Los monosacáridos se caracterizan por ser sustancias con sabor dulce (la mayoría son azúcares) que cristalizan dando sólidos blancos. Todos ellos son solubles en agua (por grupos polares –OH y =O) y tienen poder reductor (el C=O capta OH-, originándose, y se transforma en COOH). La presencia de del grupo carbonilo (aldehído o cetona) les hace reductores frente a determinadas sustancias, como la solución de Fehling. Esta propiedad nos permite determinar la presencia de monosacáridos ya que el licor de Fehling de color azul (al estar oxidado) se reduce en presencia de glúcidos y adquiere color rojo.

ISOMERÍA
La isomería es una propiedad de algunos compuestos que, teniendo la misma fórmula empírica presentan distinta estructura molecular.
Los glúcidos presentan distintos tipos de isomería: de función, espacial y óptica. Algunos monosacáridos presentan Isomería de función y/o espacial, pero todos presentan Isomería óptica.
ISOMERÍA DE FUNCIÓN.
Son compuestos que tienen idéntica fórmula molecular pero distintos grupos funcionales. Las aldosas son isomeros de las cetosas y viceversa. Ejemplo :D-glicieraldehido y Dihidroxicetona

ESTEREOISOMERÍA
Los isómeros espaciales, o estereoisómeros son moléculas que presentan la misma fórmula plana, pero distinta estructura espacial.
Aparecen cuando la molécula presenta al menos un carbono asimétrico, (o quiral) es decir, un carbono que está unido a cuatro radicales diferentes. Los radicales unidos a estos carbonos pueden disponerse en el espacio en distintas posiciones.
| No Asimétrico Posee dos sustituyentes iguales | Asimétrico Todos los sustituyentes son distintos |
|
3-hidroxi-propanal |
2,3-hidroxi-propanal |
El carbono asimétrico más alejado del grupo funcional, sirve como referencia para nombrar los distintos estereoisómeros. Cuando el grupo alcohol de este carbono se encuentra representado a su derecha, en la proyección lineal de Fischer, se dice que esa molécula es D y cuando se encuentra representado a su izquierda, se dice que esa molécula es L.
Los estereoisómeros son moléculas distintas ya que no pueden superponerse y aunque poseen las mismas propiedades físico-quimicas (calor específico, punto de fusión, etc.), presentan un comportamiento diferente frente a la luz polarizada, lo que indica que no son idénticas.
Dentro de los estereoisómeros, podemos distinguir entre los que son imágenes especulares entre si y los que no:
- Los enantiómeros (o enantiomorfos), son moléculas que tienen los grupos -OH de todos los carbonos asimétricos en posición opuesta, reflejo de la otra molécula isómera, es decir son imágenes especulares uno del otro, por lo que son también llamados isómeros especulares.
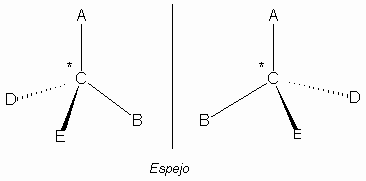
Fig. Enantiómeros
Se nombran manteniendo el mismo nombre y añadiendo únicamente la denominación D o L, según en qué posición se encuentre el grupo –OH del carbono asimétrico más alejado del grupo carbonilo.
Ej: D-gliceraldehido y L-gliceraldehido.

CHO CHO
| |
H - C- OH OH - C- H
| |
CH2OH CH2OH
D-gliceraldehido (derecha) L-gliceraldehido (izquierda)
- Se les llama epímeros a las moléculas isómeras que se diferencian en la posición de un único –OH, en un carbono asimétrico, de modo que no son imágenes especulares entre sí. Éstos tienen distinto nombre. Ej: D-ribulosa y D-xilulosa; D-Glucosa y D-manosa.
Ej: Epímeros de la glucosa.

Los compuestos con este tipo de carbonos (asimétricos) son ópticamente activos, es decir que sus disoluciones desvían el plano de la luz polarizada cuando incide sobre ellos. El sentido de la desviación va a depender de la posición que ocupan los radicales -H y -OH, respecto al C asimétrico al que se encuentran unidos. Si en una posición desvían el plano hacia la derecha, se dice que es una sustancia dextrógira, y se representa con el signo (+). Cuando los radicales están en la otra posición, lo desvían hacia la izquierda y se dice que es un isómero levógiro, y se representa con (-). Una mezcla equimolecular de isómeros ópticos contrarios seria ópticamente inactiva, es decir que no hará girar en ningún sentido el plano de la luz polarizada. A ésta mezcla se le denomina racémica o DL.
El carácter D o L de un monosacárido no está relacionado con su actividad óptica. Por esta razón, no todos los azucares de la serie D son dextrógiros, ni los de la serie L son levógiros, de modo que un monosacárido puede pertenecer a cualquiera de las 4 categorías: D(+), D(-), L(+) o L(-).
Por ejemplo, aunque la glucosa y la fructosa pertenecen a la serie D, la forma mas común de la glucosa en la naturaleza es dextrógira, mientras que la fructosa es levógira. Por eso la notación completa de sus sustancias incluye el signo referente a la serie a la que pertenecen, y el correspondiente a su actividad óptica. La mayoría de los glúcidos naturales pertenecen a la serie D.

Las D-aldosas de mayor importancia biológica son el D-gliceraldehido, la D-ribosa, la D-glucosa, la D-manosa y la D-galactosa.

Las D-cetosas mas importantes biológicamente son la dihidroxiacetona, la D-ribulosa y la D-fructosa.
ACTIVIDADES. Puedes practicar estas tabla realizando la siguiente actividad: Actividad Solución
CICLACIÓN DE LOS MONOSACÁRIDOS
Los monosacáridos solo adquieren la estructura lineal en estado solido (cristalino). En disolución, estos azucares adquieren una estructura cíclica, excepto las triosas y tetrosas. La ciclación de los monosacáridos se produce mediante un enlace hemiacetal, entre el Carbono con el grupo carbonilo y el penúltimo Carbono.
La ciclación de los monosacáridos se produce mediante un enlace hemiacetal, entre el C con el grupo carbonilo y el –OH (hidroxilo) del penúltimo Carbono. El enlace hemiacetálico consiste en un enlace covalente entre el grupo aldehído y un alcohol (en el caso de las aldosas) o un enlace hemicetal (en el caso de las cetosas), que es un es un puente de oxígeno intramolecular entre el grupo cetona y un alcohol.
Figura. Formación de los enlaces hemiacetal y hemicetal (Tomada de http://www.bioquimicaqui11601.ucv.cl/unidades/hdec/Image20.gif)
Para realizar la ciclación de una forma abierta (en proyección de Fischer), se utiliza el método de proyección de Haworth:
Proyecciones de Fisher y Haworth

Método de proyección de Haworth:
1. La forma abierta de la molécula se gira 90º
2. La molécula se representa ahora plegada, situación en la cual el penúltimo carbono (C5), sufre una rotación y que cerca del carbono con el grupo carbonilo, que reacciona con el –OH de éste, creando el enlace hemiacetal. El último carbono (C6) queda unido al C5 por encima del plano de proyección. El enlace hemiacetal mantiene el carácter reductor del monosacárido, pues no supone pérdida ni ganancia de átomos, sino una reorganización de los mismos.
3. Se cicla así la molécula y se forma una estructura pentagonal (furanosa) o hexagonal (piranosa).
4. Los grupos –OH y –H que estaban situados a la derecha en la proyección de Fischer quedan ahora hacia abajo y los que estaban a la izquierda, hacia arriba.
Cuando esto ocurre, el carbono con el grupo carbonilo se transforma en un carbono asimétrico que se denomina anomérico, lo que propicia la aparición de dos estereoisómeros, llamados anómeros. Los anómeros son precisamente, isómeros de los monosacáridos de 5 o más carbonos y que han sufrido la unión hemiacetálica, tras la cual pueden aparecer dos formas moleculares, que se diferencian en la posición del grupo hidroxilo (-OH) unido al carbono anomérico. El grupo hidroxilo puede situarse hacia abajo, obteniéndose el anómero α, o hacia arriba en cuyo caso se otiene el anómero β.
ALDOHEXOSAS
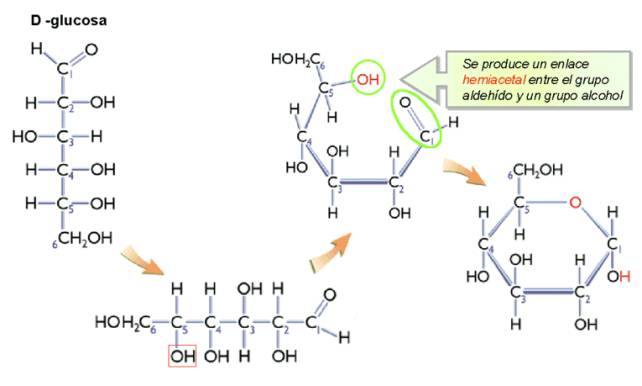
Figura. (Tomada de http://www.geocities.ws/batxillerat_biologia/glu12.jpg )
ALDOPENTOSAS
CETOHEXOSAS
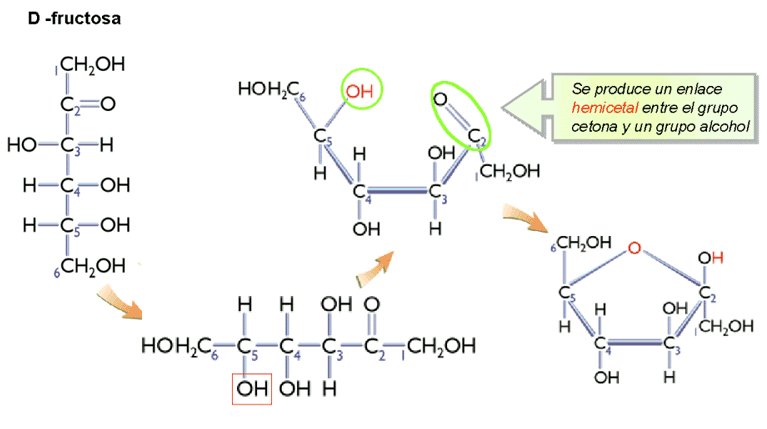
Figura. ( Tomada de http://www.geocities.ws/batxillerat_biologia/glu11.jpg)
Fig. Ciclacion de la D-Fructosa (Tomada de http://www.bioquimicaqui11601.ucv.cl/unidades/hdec/Image8.gif)
EJEMPLOS DE MONOSACÁRIDOS CICLADOS
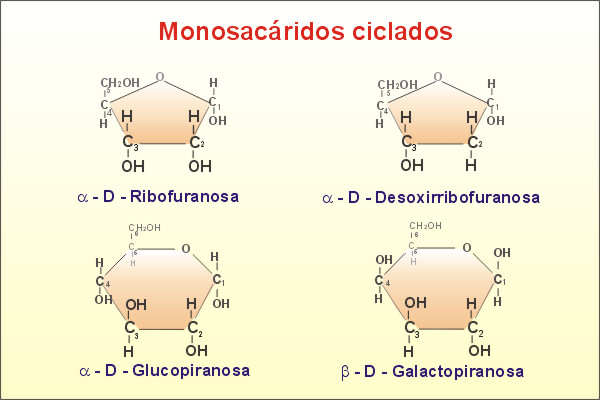
Fig. Monosacáridos ciclados. (Tomada de http://recursos.cnice.mec.es/biosfera/alumno/2bachillerato)
CLASIFICACIÓN
Según el número de carbonos se clasifican en triosas, tetrosas, pentosas, hexosas, ...
- Las Pentosas más importantes son la ribosa y la desoxirribosa, ambas aldosas, y aparecen como componentes de la constitución de nucleótidos y ácidos nucleicos. La ribulosa es una cetosa importante en la fotosíntesis pues actúa como molécula aceptora del CO2 atmosférico.

- Entre las hexosas habría que destacar la glucosa, aldosa que aparece libre o formando parte de otros hidratos de carbono. Las células la utilizan como combustible energético de uso inmediato. La galactosa, aldosa que aparece en la lactosa (azúcar de la leche) y en polisacáridos, y la fructosa, cetosa presente en la mayoría de los frutos. Aparece libre y formando sacarosa junto a la glucosa.

D- Glucosa D-Manosa D-Galactosa L- Ramnosa D- Fructosa
- En disolución los monosacáridos de más de 4 C no se encuentran de forma lineal sino que aparecen en anillo por ser, esta disposición, mucho más estable. Para su formación se redistribuyen los átomos al reaccionar el grupo –C=O (carbonilo) del aldehído o cetona con un –OH (hidroxilo), resultando un hemiacetal (puente de oxígeno intramolecular), formándose un ciclo de 5 o 6 miembros. Al anillo de 5 C se le denomina furanosa derivado del anillo de furano, y al de 6 C piranosa derivado del anillo de pirano.



